-
-
Hieff NGS? Ultima Pro DNA Library Prep Kit 全能型DNA建庫試劑盒
- 品牌:翌圣生物
- 產(chǎn)地:
- 供應(yīng)商報價:面議
-
翌圣生物科技(上海)股份有限公司
 更新時間:2024-12-24 09:03:45
更新時間:2024-12-24 09:03:45 -
銷售范圍售全國
入駐年限第1年
營業(yè)執(zhí)照已審核
- 同類產(chǎn)品DNA建庫試劑(83件)

立即掃碼咨詢
聯(lián)系方式:400-611-1883
聯(lián)系我們時請說明在儀器網(wǎng)(www.shangjinews.cn)上看到的!
掃 碼 分 享 -
為您推薦
詳細介紹
Hieff NGS® Ultima Pro DNA Library Prep Kit是針對Illumina®和MGI®高通量測序平臺專業(yè)開發(fā)設(shè)計的新一代建庫試劑盒。本產(chǎn)品采用高質(zhì)量的酶學(xué)組成,在前一代建庫試劑盒的基礎(chǔ)上,改進了DNA片段末端修復(fù)和加A效率,同時改善了接頭連接效率。本試劑盒采用新型的高保真酶,顯著提高擴增均一性和保真性,可應(yīng)用于常規(guī)動植物基因組、微生物基因組、FFPE、cfDNA、ChIP DNA等樣本,助力獲得優(yōu)異的測序數(shù)據(jù)。

產(chǎn)品組分
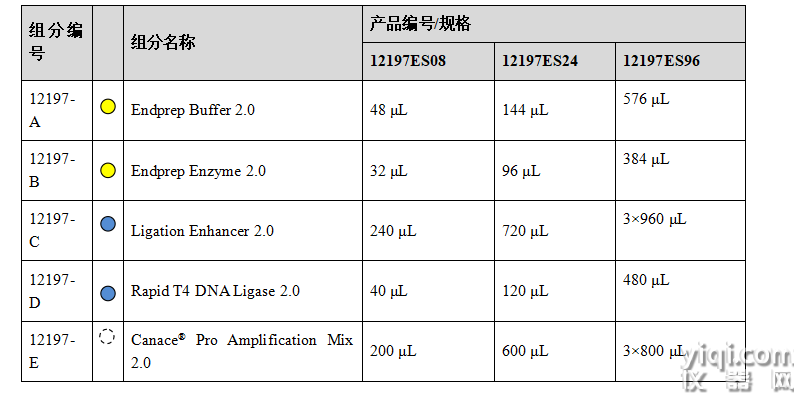
運輸與保存方法
冰袋運輸。所有組分-20 °C保存,有效期1年。
注意事項
一、關(guān)于操作
1. 為了您的安全和健康,請穿實驗服并戴一次性手套操作。
2. 請于使用前將試劑盒各組分置于室溫解凍。解凍后上下顛倒數(shù)次充分混勻,短暫離心后置于冰上待用。
3. 配制各步驟反應(yīng)液時推薦使用移液器吹打混勻或輕輕振蕩,劇烈振蕩可能會造成文庫產(chǎn)出下降。
4. 為避免樣品交叉污染,推薦使用帶濾芯的槍頭,吸取不同樣品時請更換槍頭。
5. 推薦在帶熱蓋的PCR儀中進行各步驟反應(yīng),使用前應(yīng)預(yù)熱PCR儀至反應(yīng)溫度附近。
6. PCR產(chǎn)物因操作不當(dāng)極容易產(chǎn)生氣溶膠污染,進而影響實驗結(jié)果準(zhǔn)確性。推薦將PCR反應(yīng)體系配制區(qū)和PCR產(chǎn)物純化檢測區(qū)進行強制性的物理隔離;使用專用的移液器等設(shè)備;并定時對各實驗區(qū)域進行清潔(使用0.5%次氯酸鈉或10%漂白劑進行擦拭清理),以保證實驗環(huán)境的潔凈度。
7. 本產(chǎn)品僅作科研用途!
二、關(guān)于DNA片段化
1. 本試劑盒中兼容機械法及酶切法片段化的DNA。
2. 本試劑盒兼容范圍為100 pg - 1000 ng Input DNA。應(yīng)盡可能使用A260/A280 = 1.8-2.0的高質(zhì)量Input DNA。表1中列舉了將本試劑盒應(yīng)用于常見應(yīng)用中推薦的Input DNA量。
表1 常見應(yīng)用中推薦Input DNA量
應(yīng)用
樣本類型
推薦Input DNA量
全基因組測序
復(fù)雜基因組
50 ng-1000 ng
靶向捕獲測序
復(fù)雜基因組
10 ng-1000 ng
全基因組測序,靶向捕獲測序
FFPE DNA
50 ng-1000 ng
全基因組測序,靶向捕獲測序
cfDNA/ctDNA
≥500 pg
全基因組測序
微生物基因組
≥1 ng
全基因組測序PCR-free測序
高質(zhì)量DNA
≥50 ng
【注】:上表為使用高質(zhì)量DNA時推薦的Input DNA量,當(dāng)Input DNA質(zhì)量較差或需要進行片段分選時,應(yīng)適當(dāng)上調(diào)使用量。
3. Input DNA特指投入末端修復(fù)/dA尾添加步驟中的DNA。
4. Input DNA制備過程中帶入的高濃度金屬離子螯合劑或其他鹽,可能會影響末端修復(fù)/dA尾添加步驟反應(yīng)效率,建議DNA片段化后進行磁珠純化或分選。當(dāng)使用機械法進行DNA片段化且產(chǎn)物不進行純化或長度分選而直接建庫時,請將DNA稀釋在TE Buffer中進行片段化,請勿在滅菌超純水中進行。
三、關(guān)于接頭連接(Adapter Ligation)
1. 針對Illumina®測序平臺,Yeasen提供Hieff NGS® Complete Adapter Kit for Illumina®, Set 1~Set 2 (Cat#13519~Cat#13520),試劑盒中的接頭濃度為15 μM;Hieff NGS® 384 CDI Primer for Illumina®(Cat#12412~Cat#12413),試劑盒中的接頭濃度為
15 μM;Hieff NGS® Stubby UDI Primer Kit for Illumina® (Cat#12404~Cat#12407),試劑盒中的接頭濃度為15 μM;Hieff NGS® Dual UMI UDI Adapter Kit for Illumina®,Set1~Set2 (Cat#13370~Cat#13371),試劑盒中的接頭濃度為15 μM。
2.針對MGI® 高通量測序平臺,Yeasen提供了Hieff NGS® Complete Adapter Kit for MGI®,Set 1~Set 3(Cat#13360 ~ Cat#13362),試劑盒中的接頭濃度為10 μM;Hieff NGS® 384 CDI Primer for MGI®,Set 1~Set 2(Cat#13363 ~ Cat#13364),試劑盒中的接頭濃度為10 μM;也可搭配Hieff NGS® Dual UMI UDB Adapter Kit for MGI®,Set 1~Set 2 (Cat#13367~Cat#13368)雙端UMI UDB短接頭,試劑盒中的接頭濃度為10 μM。
3. Adapter的質(zhì)量和使用濃度直接影響連接效率及文庫產(chǎn)量。Adapter用量過高可能會產(chǎn)生較多Adapter Dimer;用量較低可能會影響連接效率及文庫產(chǎn)量;使用Adapter時根據(jù)Input DNA量用TE Buffer進行相應(yīng)稀釋。
表2列舉了使用本試劑盒的不同Input DNA量推薦的針對Illumina®測序平臺的Adapter稀釋方法。
表3列舉了使用本試劑盒的不同Input DNA量推薦的針對MGI®測序平臺的Adapter稀釋方法。
表4列舉了使用本公司Hieff NGS® Dual UMI UDB Adapter Kit for MGI®,Set 1~Set 2 (Cat#13367~Cat#13368)的不同Input DNA量推薦的UMI Adapter稀釋方法。
表2 100 pg-1 μg Input DNA針對Illumina®測序平臺推薦的Adapter使用濃度
Input DNA
Adapter稀釋倍數(shù)
濃度
0.1ng ~ 1 ng
150倍稀釋
0.1 μM
1 ng ~ 10 ng
75倍稀釋
0.2 μM
10 ng ~ 25 ng
15倍稀釋
1 μM
25 ng ~ 100 ng
7.5倍稀釋
2 μM
100 ng ~ 1000 ng
3倍稀釋
5 μM
表3 100 pg-1ug Input DNA針對MGI®測序平臺推薦的Adapter使用濃度
Input DNA
Adapter稀釋倍數(shù)
濃度
<1 ng
100倍稀釋
0.1 μM
1 ng ~ 10 ng
50倍稀釋
0.2 μM
10 ng ~ 25 ng
10倍稀釋
1 μM
25 ng ~ 100 ng
5倍稀釋
2 μM
100 ng ~ 1000 ng
2倍稀釋
5 μM
表4 100 pg-1ug Input DNA針對MGI®測序平臺推薦的UMI Adapter使用濃度
Input DNA
Adapter稀釋倍數(shù)
濃度
5 ng ~ 25 ng
50倍稀釋
0.2 μM
25 ng ~ 100 ng
10倍稀釋
1 μM
100 ng ~ 1000 ng
4倍稀釋
2.5 μM
四、關(guān)于磁珠純化與分選 (Bead-based Clean Up and Size Selection)
1. DNA片段長度分選步驟可選擇在末端修復(fù)/dA尾添加之前,或接頭連接后,或文庫擴增后進行。
2. 當(dāng)Input DNA質(zhì)量≥50 ng,您可選擇在接頭連接后分選;如Input DNA質(zhì)量<50 ng,建議您在文庫擴增后進行分選。
3. Ligation Enhancer中包含高濃度的PEG,會對雙輪磁珠分選產(chǎn)生顯著影響。因此,如在接頭連接后進行長度分選,必須先進行純化步驟,再進行雙輪分選步驟;如在末端修復(fù)/dA尾添加之前或文庫擴增后進行長度分選,可直接進行雙輪磁珠分選步驟。
4. 磁珠使用前應(yīng)先平衡至室溫,否則會導(dǎo)致得率下降、分選效果不佳。
5. 磁珠每次使用前都應(yīng)充分振蕩混勻或使用移液器上下吹打充分混勻。
6. 轉(zhuǎn)移上清時,請勿吸取磁珠,即使微量殘留都將影響后續(xù)文庫質(zhì)量。
7. 磁珠漂洗使用的80%乙醇應(yīng)現(xiàn)用現(xiàn)配,否則將影響回收效率。
8. 進行長度分選時,初始樣品體積應(yīng)盡量≥100 μL,不足時請用超純水補齊。以防因樣品體積太小導(dǎo)致移液誤差增大。
9. 產(chǎn)物洗脫前應(yīng)將磁珠置于室溫干燥。干燥不充分容易造成無水乙醇殘留影響后續(xù)反應(yīng);過分干燥又會導(dǎo)致磁珠開裂進而降低純化得率。通常情況下,室溫干燥3-5 min足以讓磁珠充分干燥。
10. DNA純化或長度分選產(chǎn)物如需保存,可使用TE Buffer洗脫,產(chǎn)物可于4 °C可保存1-2周,-20 °C可保存1個月。
五、關(guān)于文庫擴增 (Library Amplification)
1. 是否需要進行文庫擴增取決于Input DNA量、Adapter是否為完整長度、應(yīng)用需要等因素。如使用非完整長度Adapter,必須進行這一步驟。如使用完整長度Adapter,當(dāng)Input DNA<200 ng時,推薦進行文庫擴增;當(dāng)Input DNA≥200 ng或者不需要進行文庫擴增時,可不進行文庫擴增。
2. 文庫擴增步驟需要嚴格控制擴增循環(huán)數(shù)。循環(huán)數(shù)不足,將導(dǎo)致文庫產(chǎn)量低;循環(huán)數(shù)過多,又將導(dǎo)致文庫偏好性增加、重復(fù)度增加、嵌合產(chǎn)物增加、擴增突變積累等多種不良后果。表5列舉了使用本試劑盒,獲得1 μg文庫的推薦循環(huán)數(shù)。
表5 100 pg-1000 ng Input DNA獲得1 μg產(chǎn)物擴增循環(huán)數(shù)推薦表
Input DNA
1 μg文庫產(chǎn)量推薦PCR循環(huán)數(shù)
1000 ng
2 - 4
500 ng
2 - 4
250 ng
4 - 6
100 ng
5 - 7
50 ng
7 - 9
10 ng
9 - 11
5 ng
10 - 12
1 ng
12 - 15
100 pg
16 - 18
【注】:
1.表5為使用200 bp左右的高質(zhì)量Input DNA測試的循環(huán)數(shù)參數(shù)。FFPE DNA質(zhì)量差異較大,當(dāng)DNA質(zhì)量較差或文庫長度較長時,需適當(dāng)提高循環(huán)數(shù)以獲取足量文庫。
2.如果建庫過程中需要進行過片段分選,推薦較高循環(huán)數(shù)進行Library Amplification;反之則參照較低循環(huán)數(shù)即可。
3.如果使用了不完整的接頭,需要擴增至少2個循環(huán),形成完整的接頭。
六、關(guān)文庫質(zhì)檢 (Library Quality Analysis)
1. 通常情況下,構(gòu)建好的文庫可通過長度分布檢測和濃度檢測來進行質(zhì)量評價。
2. 文庫濃度檢測可使用:基于雙鏈DNA熒光染料的方法,如Qubit®、PicoGreen®等;基于qPCR絕對定量的方法。
3. 文庫濃度檢測不可使用:基于光譜檢測的方法,如NanoDrop®等。
4. 推薦使用qPCR方法進行文庫濃度檢測:Qubit®、PicoGreen®等基于雙鏈DNA熒光染料的濃度測定方法時,無法有效區(qū)分單端連接Adapter的產(chǎn)物、兩端均未連接Adapter的產(chǎn)物以及其他不完整雙鏈結(jié)構(gòu)產(chǎn)物;qPCR絕對定量基于PCR擴增原理,僅定量樣品中兩端Adapter完整的文庫(即可測序的文庫),可排除單端或雙端都不連接Adapter的不可測序文庫的干擾。
5. 文庫長度分布檢測,可通過Agilent Bioanalyzer 2100等基于毛細管電泳或微控流原理的設(shè)備進行檢測。
使用方法
一、自備材料
1. 純化磁珠:Cat#12601,Hieff NGS® DNA Selection Beads或Cat#A63880,AMPure XP Beads或其他等效產(chǎn)品。
2. DNA質(zhì)控:Agilent Technologies 2100 Bioanalyzer或其他等效產(chǎn)品。
3. DNA Adapter:可選Yeasen 官網(wǎng)的Hieff NGS® Complete Adapter Kit for Illumina®, Set 1~Set 2 (Cat#13519~Cat#13520);雙端384種CDI Primers:Hieff NGS® 384 CDI Primer for Illumina®, Set 1~Set 2 (Cat#12412~Cat#12413);雙端384種UDI Primers:Hieff NGS® Stubby UDI Primer Kit for Illumina® (Cat#12404~Cat#12407),Hieff NGS® Dual UMI UDI Adapter Kit for Illumina®,Set1~Set2 (Cat#13370~Cat#13371)DNA 文庫構(gòu)建專用配套試劑盒,
或者可選匹配MGI平臺的接頭:Hieff NGS® Complete Adapter Kit for MGI®,Set 1~Set 3(Cat#13360 ~ Cat#13362);Hieff NGS® 384 CDI Primer for MGI®,Set 1~Set 2(Cat#13363 ~ Cat#13364);Hieff NGS® Dual UMI UDB Adapter Kit for MGI®,Set 1~Set 2 (Cat#13367~Cat#13368);接頭詳細介紹信息參考上面注意事項中的第三部分“關(guān)于接頭連接”。
4.DNA Primer Mix:Cat#12190,DNA Library Prep Primer Mix for Illumina® 或Cat#12191,DNA Library Prep Primer Mix for MGI®
5. 其他材料:無水乙醇、滅菌超純水、TE Buffer (10 mM Tris-HCl,pH 8.0-8.5+1 mM EDTA)、低吸附EP管、PCR管、磁力架、PCR儀等。
二、操作流程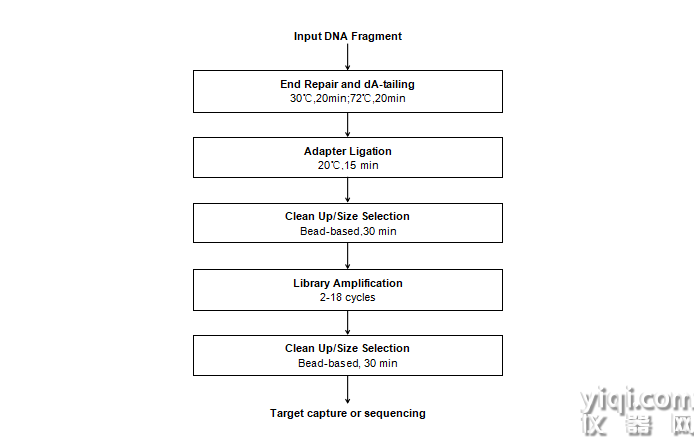
圖1 Hieff NGS® Ultima Pro DNA Library Prep Kit for Illumina操作流程
三、操作步驟
3.1 末端修復(fù)/dA尾添加 (End Repair/dA-Taling)
該步驟將片段化后的Input DNA末端補平,并進行5’端磷酸化和3’端加dA尾。
1. 將表6中各試劑解凍后,顛倒混勻,置于冰上備用。
2. 于無菌PCR管中配制表6所示反應(yīng)體系。
表6 末端修復(fù)/dA尾添加PCR反應(yīng)體系
名稱
體積 (μL)
Fragmented DNA
x
Endprep Buffer 2.0
6
Endprep Enzyme 2.0
4
ddH2O
Up to 60
3. 使用移液器輕輕吹打或振蕩混勻,并短暫離心將反應(yīng)液離心至管底。
4. 將上述PCR管置于PCR儀,設(shè)置表7所示反應(yīng)程序,進行末端修復(fù)/dA尾添加反應(yīng)。
表7 末端修復(fù)/dA尾添加PCR反應(yīng)程序
溫度
時間
熱蓋105 °C
On
30 °C
20 min
72 °C
20 min
4 °C
Hold
3.2 接頭連接 (Adapter Ligation)
該步驟將3.1步驟的產(chǎn)物末端,連接特定的Illumina®接頭。
1. 根據(jù)Input DNA量按表2-4稀釋Adapter至合適濃度。
2. 將表8中各試劑解凍后顛倒混勻,置于冰上備用。
3. 于3.1步驟PCR管中配制表8所示反應(yīng)體系。
表8 Adapter Ligation PCR體系
名稱
體積 (μL)
dA-tailed DNA(3.1步驟產(chǎn)物)
60
Ligation Enhancer 2.0
30*
DNA Adapter
5**
Rapid T4 DNA Ligase 2.0
5
【注】:*Ligation Enhancer比較粘稠,請上下顛倒、振蕩,充分混勻并瞬時離心后使用。
**本公司接頭濃度與常規(guī)商業(yè)化試劑盒一致,Illumina®平臺皆為15 μM,MGI®平臺皆為10 μM。
4. 使用移液器輕輕吹打或振蕩混勻,并短暫離心將反應(yīng)液收集至管底。
5. 將PCR管置于PCR儀中,設(shè)置表9所示反應(yīng)程序,進行接頭連接反應(yīng):
表9 Adapter Ligation PCR反應(yīng)程序
溫度
時間
熱蓋
Off
20 °C
15 min
4 °C
Hold
【注】:當(dāng)Input DNA量較低,實驗效果不理想時,可嘗試將連接時間延長一倍。
3.3 連接產(chǎn)物磁珠純化 (Post-Ligation Clean Up)
該步驟使用磁珠對3.2步驟的產(chǎn)物進行直接純化或分選。純化可除去未連接的Adapter或Adapter Dimer等無效產(chǎn)物。直接純化步驟參考3.3.1,分選步驟參考3.3.2。3.3.1 純化操作步驟:
1. 準(zhǔn)備工作:將Hieff NGS® DNA Selection Beads磁珠由冰箱中取出,室溫平衡至少30 min。配制80%乙醇。
2. 渦旋振蕩或充分顛倒磁珠以保證充分混勻。
3. 吸取60 μL Hieff NGS® DNA Selection Beads (0.6×,Beads:DNA=0.6:1)至Adapter Ligation產(chǎn)物中,渦旋混勻或移液器吹打10次混勻,室溫孵育5 min。
4. 將PCR管短暫離心并置于磁力架中分離磁珠和液體,待溶液澄清后(約5 min),小心移除上清。
5. 保持PCR管始終置于磁力架中,加入200 μL新鮮配制的80%乙醇漂洗磁珠,室溫孵育30 sec后,小心移除上清。
6. 重復(fù)步驟5,總計漂洗兩次。
7. 保持PCR管始終置于磁力架中,開蓋空氣干燥磁珠至剛剛出現(xiàn)龜裂(不超過5 min)。
8. 將PCR管從磁力架中取出,進行洗脫:
1)如產(chǎn)物無需進行片段分選,直接加入21 μL ddH2O,渦旋振蕩或使用移液器輕輕吹打至充分混勻,室溫靜置5 min。將PCR管短暫離心并置于磁力架中靜置,待溶液澄清后(約5 min),小心移取20 μL上清至新PCR管中,切勿觸碰磁珠。
【注】:如純化產(chǎn)物如需保存,可使用TE Buffer洗脫。
2)如產(chǎn)物需進行雙輪分選,加入102 μL ddH2O,渦旋振蕩或使用移液器輕輕吹打至充分混勻,室溫靜置5 min。將PCR管短暫離心并置于磁力架中靜置,待溶液澄清后(約5 min),小心移取100 μL上清至新PCR管中,切勿觸碰磁珠。
【注】:如純化產(chǎn)物如需保存,可使用TE Buffer洗脫。
3.3.2 雙輪分選操作步驟:
1. 準(zhǔn)備工作:將Hieff NGS® DNA Selection Beads磁珠由冰箱中取出,室溫平衡約30 min。配制80%乙醇。
2. 請渦旋振蕩或充分顛倒磁珠以保證混勻。
3. 根據(jù)DNA片段長度要求,參考表10向上述100 μL DNA上清中加入第一輪分選磁珠,渦旋或移液器吹打10次混勻。
表10 磁珠文庫分選推薦比例
DNA文庫大小(插入片段)
150 - 250 bp
200-300 bp
300-400 bp
400-500 bp
DNA文庫大小
250-350 bp
350-450 bp
450-550 bp
550-650 bp
第一輪體積比 (Beads:DNA)
0.80×
0.70×
0.60×
0.55×
第二輪體積比 (Beads:DNA)
0.20×
0.20×
0.20×
0.15×
【注】:表中“×”表示樣品DNA體積。如文庫插入片段長度為250 bp,樣品DNA體積為100 μL,則第一輪分選磁珠使用體積為0.70×100 μL=70 μL;第二輪分選磁珠使用體積為0.20×100 μL=20 μL;表中所推薦比例是針對于Adapter Ligated Insert DNA (Post Ligation),如果用戶在接頭連接前進行分選,請采用Hieff NGS® DNA Selection Beads (Cat#12601)說明書中推薦的比例。
4. 室溫孵育5 min。
5. 將PCR管短暫離心并置于磁力架中,待溶液澄清后(約5 min),小心轉(zhuǎn)移上清到干凈的離心管中。
6. 參考表8向上清中加入第二輪分選磁珠。
7. 渦旋混勻或移液器吹打10次混勻,室溫靜置5 min。
8. 將PCR管短暫離心并置于磁力架中,待溶液澄清后(約5 min),小心移除上清。
9. 保持PCR管始終處于磁力架中,加入200 μL新鮮配制的80%乙醇漂洗磁珠,室溫孵育30 sec,小心移除上清。
10. 重復(fù)步驟9。
11. 保持PCR管始終處于磁力架中,開蓋干燥磁珠至剛剛出現(xiàn)龜裂(約5 min)。
12. 將PCR管從磁力架中取出,加入適量21 μL ddH2O,渦旋振蕩或使用移液器輕輕吹打充分混勻,室溫靜置5 min。
13. 將PCR管短暫離心并置于磁力架中分離磁珠和液體。待溶液澄清后(約5 min),小心轉(zhuǎn)移20 μL上清至干凈的管中。
3.4 文庫擴增 (Library Amplification)
該步驟將對純化或長度分選后的接頭連接產(chǎn)物進行PCR擴增富集。
1. 將表11中試劑解凍后顛倒混勻,置于冰上備用。
2. 于無菌PCR管中配制表11所示反應(yīng)體系。
表11 PCR擴增反應(yīng)體系
名稱
體積 (μL)
Adapter Ligated DNA(3.3步驟產(chǎn)物)
20
Canace® Pro Amplification Mix 2.0
25
Primer mix
5
【注】:*如果使用的是完整接頭(Cat#13519~Cat#13520),使用DNA Library Prep Primer Mix for Illumina(Cat#12190)試劑盒中的Primer Mix進行擴增;如果使用的是MGI接頭(Cat#13360 ~ Cat#13362),使用DNA Library Prep Primer Mix for MGI(Cat#12191)試劑盒中的Primer Mix進行擴增;如果使用了不完整的接頭(Cat#12412~Cat#12413、Cat#12404~Cat#12407),請參照上述試劑盒說明書,使用其中配備的Index Primer進行擴增。
3. 使用移液器輕輕吹打或振蕩混勻,并短暫離心將反應(yīng)液收集至管底。
4. 將PCR管置于PCR儀中,設(shè)置表12所示反應(yīng)程序,進行PCR擴增。
表12 PCR擴增反應(yīng)程序
溫度
時間
循環(huán)數(shù)
98 °C
1 min
1
98 °C
10 sec
參照注意事項中表5
60 °C
30 sec
72 °C
30 sec
72 °C
5 min
1
4 °C
Hold
-
3.5 擴增產(chǎn)物磁珠純化或分選 (Post Amplification Clean Up/Size Selection)同3.3.1步驟中純化操作步驟。使用Hieff NGS® DNA Selection Beads (0.9×,Beads:DNA=0.9:1)純化文庫擴增產(chǎn)物。
如需分選,操作方法同3.3.2雙輪分選步驟(純化步驟可省略)。
3.6 文庫質(zhì)量控制
通常情況下,構(gòu)建好的文庫可通過濃度檢測和長度分布檢測來進行質(zhì)量評價,具體請參見注意事項六。
HB20221205
您可能感興趣的產(chǎn)品
-
 Hieff NGS? Ultima Pro DNA Library Prep Kit 全能型DNA建庫試劑盒
Hieff NGS? Ultima Pro DNA Library Prep Kit 全能型DNA建庫試劑盒
-
 Hieff NGS??DNA Library Prep Kit 2.0 全能型DNA建庫試劑盒2.0
Hieff NGS??DNA Library Prep Kit 2.0 全能型DNA建庫試劑盒2.0
-
 Hieff NGS?Ultima Pro DNA Library Prep Kit for MGI?V2 全能型DNA建庫試劑盒MGI平臺V2
Hieff NGS?Ultima Pro DNA Library Prep Kit for MGI?V2 全能型DNA建庫試劑盒MGI平臺V2
-
 Hieff NGS?Ultima Pro PCR Free DNA Library Prep Kit ?V2 全能型DNA建庫試劑盒(PCR-Free) V2
Hieff NGS?Ultima Pro PCR Free DNA Library Prep Kit ?V2 全能型DNA建庫試劑盒(PCR-Free) V2
-
 Hieff NGS? Methyl-seq DNA Library Prep Kit for MGI? DNA甲基化建庫試劑盒
Hieff NGS? Methyl-seq DNA Library Prep Kit for MGI? DNA甲基化建庫試劑盒
-
 Hieff NGS<sup>?</sup> Ultima Pro PCR Free DNA Library Prep Kit 全能型DNA建庫試劑盒(PCR-Free)
Hieff NGS<sup>?</sup> Ultima Pro PCR Free DNA Library Prep Kit 全能型DNA建庫試劑盒(PCR-Free)
-
 建庫試劑盒Hieff NGS Ultima Pro DNA Library Prep Kit for MGI||||Yeasen/翌圣|96 libraries
建庫試劑盒Hieff NGS Ultima Pro DNA Library Prep Kit for MGI||||Yeasen/翌圣|96 libraries
-
 建庫試劑盒Hieff NGS Ultima Pro DNA Library Prep Kit for MGI||||Yeasen/翌圣|16 libraries
建庫試劑盒Hieff NGS Ultima Pro DNA Library Prep Kit for MGI||||Yeasen/翌圣|16 libraries
-
 Hieff NGS? OnePot Pro DNA Library Prep Kit V4 一步法DNA酶切建庫試劑盒V4
Hieff NGS? OnePot Pro DNA Library Prep Kit V4 一步法DNA酶切建庫試劑盒V4
-
 建庫試劑盒Hieff? NGS?Ultima?DNA Library Prep Kit for MGI||||Yeasen/翌圣|192 libraries
建庫試劑盒Hieff? NGS?Ultima?DNA Library Prep Kit for MGI||||Yeasen/翌圣|192 libraries
-
 Hieff NGS<sup>?</sup> Ultima DNA Library Prep Kit for Illumina<sup>?</sup> 全能型DNA建庫試劑盒
Hieff NGS<sup>?</sup> Ultima DNA Library Prep Kit for Illumina<sup>?</sup> 全能型DNA建庫試劑盒
-
 Hieff NGS? DNA Library Prep Kit
Hieff NGS? DNA Library Prep Kit