-

-
Hieff NGS<sup>?</sup> Ultima DNA Library Prep Kit for Illumina<sup>?</sup> 全能型DNA建庫試劑盒
- 品牌:翌圣生物
- 產(chǎn)地:
- 供應(yīng)商報(bào)價(jià):面議
-
翌圣生物科技(上海)股份有限公司
 更新時(shí)間:2024-12-24 09:03:45
更新時(shí)間:2024-12-24 09:03:45 -
銷售范圍售全國
入駐年限第1年
營業(yè)執(zhí)照已審核
- 同類產(chǎn)品DNA建庫試劑(83件)

立即掃碼咨詢
聯(lián)系方式:400-611-1883
聯(lián)系我們時(shí)請說明在儀器網(wǎng)(www.shangjinews.cn)上看到的!
掃 碼 分 享 -
為您推薦
詳細(xì)介紹
Hieff NGS® Ultima DNA Library Prep Kit for Illumina®是針對Illumina®高通量測序平臺(tái)定向優(yōu)化而成的新一代建庫試劑盒。作為全新的升級(jí)版本,本產(chǎn)品采用高質(zhì)量的酶學(xué)組成,簡化的操作流程,可顯著提高低質(zhì)量樣本文庫轉(zhuǎn)化率與擴(kuò)增效率,具有廣泛的樣本適應(yīng)性,同時(shí)兼容FFPE、cfDNA、ChIP DNA等樣本,助力獲得優(yōu)異的測序數(shù)據(jù)。
- 適用500 pg-1 μg DNA樣本
- 兼容cfDNA、FFPE等低質(zhì)量樣本
- 高效的文庫轉(zhuǎn)化率與擴(kuò)增效率
- 多樣本驗(yàn)證可獲得優(yōu)異的文庫與測序數(shù)據(jù)
- 嚴(yán)格的批次性能與穩(wěn)定性質(zhì)控
產(chǎn)品組分
組分編號(hào)與名稱
12199ES96
12199-A
Endprep Mix
960 μL
12199-B
Ligation Enhancer
4×720 μL
12199-C
Fast T4 DNA Ligase
480 μL
12199-D
2×Ultima Amplification Mix
4×600 μL
12199-E
Primer Mix
480 μL
運(yùn)輸與保存方法
-25~-15℃保存,有效期1年。
注意事項(xiàng)
一、關(guān)于操作
1. 本產(chǎn)品僅作科研用途!為了您的安全和健康,請穿實(shí)驗(yàn)服并戴一次性手套操作。
2. 請于使用前將試劑盒各組分置于室溫解凍。解凍后上下顛倒數(shù)次充分混勻,短暫離心后置于冰上待用。
3. 配制各步驟反應(yīng)液時(shí)推薦使用移液器吹打混勻或輕輕振蕩,劇烈振蕩可能會(huì)造成文庫產(chǎn)出下降。
4. 為避免樣品交叉污染,推薦使用帶濾芯的槍頭,吸取不同樣品時(shí)請更換槍頭。
5. 推薦在帶熱蓋的PCR儀中進(jìn)行各步驟反應(yīng),使用前應(yīng)預(yù)熱PCR儀至反應(yīng)溫度附近。
6. PCR產(chǎn)物因操作不當(dāng)極容易產(chǎn)生氣溶膠污染,進(jìn)而影響實(shí)驗(yàn)結(jié)果準(zhǔn)確性。推薦將PCR反應(yīng)體系配制區(qū)和PCR產(chǎn)物純化檢測區(qū)進(jìn)行強(qiáng)制性的物理隔離;使用專用的移液器等設(shè)備;并定時(shí)對各實(shí)驗(yàn)區(qū)域進(jìn)行清潔(使用0.5%次氯酸鈉或10%漂白劑進(jìn)行擦拭清理),以保證實(shí)驗(yàn)環(huán)境的潔凈度。
二、關(guān)于DNA片段化
1. 本試劑盒中兼容機(jī)械法及酶切法片段化的DNA。
2. 本試劑盒兼容范圍為500 pg – 1 μg Input DNA。應(yīng)盡可能使用A260/A280 = 1.8-2.0的高質(zhì)量Input DNA。表1中列舉了將本試劑盒應(yīng)用于常見應(yīng)用中推薦的Input DNA量。
表1 常見應(yīng)用中推薦Input DNA量
應(yīng)用
樣本類型
推薦Input DNA量
全基因組測序
復(fù)雜基因組
50 ng-1 μg
靶向捕獲測序
復(fù)雜基因組
10 ng-1 μg
全基因組測序,靶向捕獲測序
FFPE DNA
≥50 ng
全基因組測序,靶向捕獲測序
cfDNA/ctDNA
≥500 pg
全基因組測序
微生物基因組
≥1 ng
全基因組測序PCR-free測序
高質(zhì)量DNA
≥100 ng
免疫共沉淀測序
ChIP-DNA
≥500 pg
靶向測序
擴(kuò)增子
≥500 pg
【注】:上表為使用高質(zhì)量DNA時(shí)推薦的Input DNA量,當(dāng)Input DNA質(zhì)量較差或需要進(jìn)行片段分選時(shí),應(yīng)適當(dāng)上調(diào)使用量。
3. Input DNA特指投入末端修復(fù)/dA尾添加步驟中的DNA。
4. Input DNA制備過程中帶入的高濃度金屬離子螯合劑或其他鹽,可能會(huì)影響末端修復(fù)/dA尾添加步驟反應(yīng)效率,建議DNA片段化后進(jìn)行磁珠純化或分選。當(dāng)使用機(jī)械法進(jìn)行DNA片段化且產(chǎn)物不進(jìn)行純化或長度分選而直接建庫時(shí),請將DNA稀釋在TE Buffer中進(jìn)行片段化,請勿在滅菌超純水中進(jìn)行。當(dāng)使用酶切法進(jìn)行片段化且產(chǎn)物不進(jìn)行純化或長度分選而直接建庫時(shí),請確認(rèn)Stop Buffer中不包含過量的金屬離子螯合劑。如條件不滿足,可先將片段化產(chǎn)物純化或長度分選后溶于TE buffer或滅菌超純水中(≤50 μL),再進(jìn)行文庫構(gòu)建。
三、關(guān)于接頭連接(Adapter Ligation)
1.本公司可提供長接頭(Indexed Adapter)試劑盒和短接頭(也稱為小Y接頭、不完整接頭)試劑盒,客戶可根據(jù)實(shí)驗(yàn)需求進(jìn)行選擇。
目前有48種Complete Adapters: Hieff NGS® Complete Adapter Kit for Illumina®, Set 1~Set 4 (Cat#12615~Cat#12618);
單端 96種Index Primers: Hieff NGS® 96 Single Index Primers Kit for Illumina®, Set 1~Set 2 (Cat#12611~Cat#12612);
雙端384種Index Primers: Hieff NGS® 384 CDI Primer for Illumina®, Set 1~Set 2 (Cat#12412~Cat#12413)。
2. Adapter的質(zhì)量和使用濃度直接影響連接效率及文庫產(chǎn)量。Adapter用量過高可能會(huì)產(chǎn)生較多Adapter Dimer;用量較低可能會(huì)影響連接效率及文庫產(chǎn)量。表2列舉了使用本試劑盒,不同Input DNA量推薦的Adapter使用量。
表2 500 pg-1 μg Input DNA推薦的Adapter使用濃度
Input DNA
Adapter : Input DNA摩爾比
Input DNA
Adapter : Input DNA摩爾比
1 μg
10:1
50 ng
100:1
500 ng
20:1
25 ng
200:1
250 ng
40:1
1 ng
200:1
100 ng
100:1
500 pg
400:1
【注】:Input DNA摩爾數(shù)(pmol)≈ Input DNA質(zhì)量(ng)/ [0.66 × Input DNA平均長度(bp)]。
四、關(guān)于磁珠純化與分選(Bead-based Clean Up and Size Selection)
1. DNA片段長度分選步驟可選擇在末端修復(fù)/dA尾添加之前,或接頭連接后,或文庫擴(kuò)增后進(jìn)行。
2. 當(dāng)Input DNA質(zhì)量≥50 ng,您可選擇在接頭連接后分選;如Input DNA質(zhì)量<50 ng,建議您在文庫擴(kuò)增后進(jìn)行分選。
3. Ligation Enhancer中包含高濃度的PEG,會(huì)對雙輪磁珠分選產(chǎn)生顯著影響。因此,如在接頭連接后進(jìn)行長度分選,必須先進(jìn)行純化步驟,再進(jìn)行雙輪分選步驟;如在末端修復(fù)/dA尾添加之前或文庫擴(kuò)增后進(jìn)行長度分選,可直接進(jìn)行雙輪磁珠分選步驟。
4. 磁珠使用前應(yīng)先平衡至室溫,否則會(huì)導(dǎo)致得率下降、分選效果不佳。
5. 磁珠每次使用前都應(yīng)充分振蕩混勻或使用移液器上下吹打充分混勻。
6. 轉(zhuǎn)移上清時(shí),請勿吸取磁珠,即使微量殘留都將影響后續(xù)文庫質(zhì)量。
7. 磁珠漂洗使用的80%乙醇應(yīng)現(xiàn)用現(xiàn)配,否則將影響回收效率。
8. 進(jìn)行長度分選時(shí),初始樣品體積應(yīng)盡量≥100 μL,不足時(shí)請用超純水補(bǔ)齊。以防因樣品體積太小導(dǎo)致移液誤差增大。
9. 產(chǎn)物洗脫前應(yīng)將磁珠置于室溫干燥。干燥不充分容易造成無水乙醇?xì)埩粲绊懞罄m(xù)反應(yīng);過分干燥又會(huì)導(dǎo)致磁珠開裂進(jìn)而降低純化得率。通常情況下,室溫干燥3-5 min足以讓磁珠充分干燥。
10. DNA純化或長度分選產(chǎn)物如需保存,可使用TE Buffer洗脫,產(chǎn)物可于4 °C可保存1-2周,-20 °C可保存1個(gè)月。
五、關(guān)于文庫擴(kuò)增(Library Amplification)
1. 是否需要進(jìn)行文庫擴(kuò)增取決于Input DNA量、Adapter是否為完整長度、應(yīng)用需要等因素。如使用非完整長度Adapter,必須進(jìn)行這一步驟。如使用完整長度Adapter,當(dāng)Input DNA<200 ng時(shí),推薦進(jìn)行文庫擴(kuò)增;當(dāng)Input DNA≥200 ng或者不需要進(jìn)行文庫擴(kuò)增時(shí),可不進(jìn)行文庫擴(kuò)增。
2. 文庫擴(kuò)增步驟需要嚴(yán)格控制擴(kuò)增循環(huán)數(shù)。循環(huán)數(shù)不足,將導(dǎo)致文庫產(chǎn)量低;循環(huán)數(shù)過多,又將導(dǎo)致文庫偏好性增加、重復(fù)度增加、嵌合產(chǎn)物增加、擴(kuò)增突變積累等多種不良后果。表3列舉了本試劑盒,獲得100 ng或1000 ng文庫的所需循環(huán)數(shù)。
表3 500 pg-1 μg Input DNA獲得100 ng或1000 ng產(chǎn)物擴(kuò)增循環(huán)數(shù)推薦表
Input DNA
Number of cycles required to generate
100 ng
1000 ng
1 μg
-
2 - 4*
500 ng
-
3 - 5
250 ng
1 - 3*
4 - 7
100 ng
2 - 4*
5 - 8
50 ng
4 - 6
7 - 10
10 ng
6 - 8
8 - 12
5 ng
7 - 9
10 - 14
1 ng
9 - 11
12 - 15
500 pg
11 - 13
13 - 16
【注】:*如果使用了不完整的接頭,需要擴(kuò)增1-3個(gè)循環(huán),形成完整的接頭。建庫過程中進(jìn)行過長度分選時(shí)參照較高循環(huán)數(shù)擴(kuò)增。
六、關(guān)于文庫質(zhì)檢(Library Quality Analysis)
1. 通常情況下,構(gòu)建好的文庫可通過長度分布檢測和濃度檢測來進(jìn)行質(zhì)量評價(jià)。
2. 文庫濃度檢測可使用:基于雙鏈DNA熒光染料的方法,如Qubit®、PicoGreen®等;基于qPCR絕對定量的方法。
3. 文庫濃度檢測不可使用:基于光譜檢測的方法,如NanoDrop®等。
4. 推薦使用qPCR方法進(jìn)行文庫濃度檢測:Qubit®、PicoGreen®等基于雙鏈DNA熒光染料的濃度測定方法時(shí),無法有效區(qū)分單端連接Adapter的產(chǎn)物、兩端均未連接Adapter的產(chǎn)物以及其他不完整雙鏈結(jié)構(gòu)產(chǎn)物;qPCR絕對定量基于PCR擴(kuò)增原理,僅定量樣品中兩端Adapter完整的文庫(即可測序的文庫),可排除單端或雙端都不連接Adapter的不可測序文庫的干擾。
5. 文庫長度分布檢測,可通過Agilent Bioanalyzer 2100等基于毛細(xì)管電泳或微控流原理的設(shè)備進(jìn)行檢測。
使用方法
一、自備材料
1. 純化磁珠:Cat#12601,Hieff NGS® DNA Selection Beads或Cat#A63880,AMPure XP Beads或其他等效產(chǎn)品。
2. DNA質(zhì)控:Agilent Technologies 2100 Bioanalyzer或其他等效產(chǎn)品。
3. DNA Adapter:可選Yeasen Complete Adapter: Hieff NGS® Complete Adapter Kit for Illumina®, Set 1-4 (Cat#12615-12618);
單端 96種 Index Primers: Hieff NGS® 96 Single Index Primers Kit for Illumina® , Set 1-2 (Cat#12611~Cat#12612);
雙端 384 種 Index Primers: Hieff NGS® 384 Dual Index Primers Kit for Illumina® , Set 1-2 (Cat#12613~Cat#12614)。
或其他等效產(chǎn)品。
4. 其他材料:無水乙醇、滅菌超純水、TE Buffer (10 mM Tris-HCl (pH 8.0-8.5), 0.1 mM EDTA)、低吸附EP管、PCR管、磁力架、PCR儀等。
二、操作流程

圖1 Ultima DNA建庫試劑盒操作流程
三、操作步驟
3.1 末端修復(fù)/dA尾添加(End Repair/dA-Taling)
該步驟將Input DNA末端補(bǔ)平,并進(jìn)行5’端磷酸化和3’端加dA尾。
1. 將表4中各試劑解凍后,顛倒混勻,置于冰上備用。
2. 于無菌PCR管中配制表4所示反應(yīng)體系。
表4 末端修復(fù)/dA尾添加PCR反應(yīng)體系
名稱
體積 (μL)
Fragmented DNA
x
Endprep Mix
10
ddH2O
Up to 60
3. 使用移液器輕輕吹打或振蕩混勻,并短暫離心將反應(yīng)液離心至管底。
4. 將上述PCR管置于PCR儀,設(shè)置表5所示反應(yīng)程序,進(jìn)行末端修復(fù)/dA尾添加反應(yīng)。
表5 末端修復(fù)/dA尾添加PCR反應(yīng)程序
溫度
時(shí)間
熱蓋105 °C
On
30 °C
20 min
72 °C
20 min
4 °C
Hold
3.2 接頭連接(Adapter Ligation)
該步驟將3.1步驟的產(chǎn)物末端,連接特定的Illumina®接頭。
1. 根據(jù)Input DNA量按表2稀釋Adapter至合適濃度。
2. 將表6中各試劑解凍后顛倒混勻,置于冰上備用。
3. 于3.1步驟PCR管中配制表6所示反應(yīng)體系。
表6 Adapter Ligation PCR體系
名稱
體積 (μL)
dA-tailed DNA(3.1步驟產(chǎn)物)
60
Ligation Enhancer
30*
Fast T4 DNA Ligase
5
DNA Adapter
5**
【注】:*Ligation Enhancer比較粘稠,請上下顛倒、振蕩,充分混勻并瞬時(shí)后離心使用。
**本公司接頭濃度與常規(guī)商業(yè)化試劑盒一致,皆為15 μM。
【接頭添加計(jì)算舉例】:當(dāng)Input DNA為100 ng,Input DNA長度為300 bp時(shí),接頭應(yīng)該添加多少?
第一步,計(jì)算Input DNA摩爾數(shù)。公式:Input DNA摩爾數(shù)(pmol)≈ Input DNA質(zhì)量(ng)/ [0.66 × Input DNA平均長度(bp)];
Input DNA 摩爾數(shù)(pmol)=100÷(0.66×300)=0.5 pmol;
第二步,計(jì)算接頭添加摩爾數(shù)。根據(jù)注意事項(xiàng)三表2查詢接頭添加比例;
根據(jù)表2,查得Input DNA 100ng時(shí)接頭添加比例100:1,則接頭添加摩爾數(shù)=100×0.5 pmol=50 pmol;
第三步,計(jì)算接頭添加體積。接頭濃度=15 μmol/L(如使用其他接頭,濃度需要依據(jù)其他接頭濃度參數(shù));
接頭添加體積=接頭添加摩爾數(shù)(50 pmol)÷接頭濃度(15 μmol/L)=3.34 μL(注:15 μmol/L=15 pmol/μL)
綜上,接頭可添加3.4 μL,加1.6 μL水補(bǔ)齊至5 μL。(注:接頭最大加入體積不超過5 μL)。
4. 使用移液器輕輕吹打或振蕩混勻,并短暫離心將反應(yīng)液收集至管底。
5. 將PCR管置于PCR儀中,設(shè)置表7所示反應(yīng)程序,進(jìn)行接頭連接反應(yīng):
表7 Adapter Ligation PCR反應(yīng)程序
溫度
時(shí)間
熱蓋105 °C
Off
20 °C
15 min
4 °C
Hold
【注】:當(dāng)Input DNA量較低,實(shí)驗(yàn)效果不理想時(shí),可嘗試將連接時(shí)間延長一倍。
3.3 連接產(chǎn)物磁珠純化(Post-Ligation Clean Up)
該步驟使用磁珠對3.2步驟的產(chǎn)物進(jìn)行純化或分選。純化可除去未連接的Adapter或Adapter Dimer等無效產(chǎn)物。
3.3.1 純化操作步驟
1. 準(zhǔn)備工作:將Hieff NGS® DNA Selection Beads磁珠由冰箱中取出,室溫平衡至少30 min。配制80%乙醇。
2. 渦旋振蕩或充分顛倒磁珠以保證充分混勻。
3. 吸取60 μL Hieff NGS® DNA Selection Beads (0.6×,Beads:DNA=0.6:1)至Adapter Ligation產(chǎn)物中,渦旋混勻或移液器吹打10次混勻,室溫孵育5 min。
4. 將PCR管短暫離心并置于磁力架中分離磁珠和液體,待溶液澄清后(約5 min),小心移除上清。
5. 保持PCR管始終置于磁力架中,加入200 μL新鮮配制的80%乙醇漂洗磁珠,室溫孵育30 sec后,小心移除上清。
6. 重復(fù)步驟5,總計(jì)漂洗兩次。
7. 保持PCR管始終置于磁力架中,開蓋空氣干燥磁珠至剛剛出現(xiàn)龜裂(不超過5 min)。
8. 將PCR管從磁力架中取出,進(jìn)行洗脫:
1) 如產(chǎn)物無需進(jìn)行片段分選,直接加入21 μL ddH2O,渦旋振蕩或使用移液器輕輕吹打至充分混勻,室溫靜置5 min。【注:如純化產(chǎn)物如需保存,可使用TE Buffer洗脫】。將PCR管短暫離心并置于磁力架中靜置,待溶液澄清后(約5 min),小心移取20 μL上清至新PCR管中,切勿觸碰磁珠。
2) 如產(chǎn)物需進(jìn)行雙輪分選,加入102 μL ddH2O,渦旋振蕩或使用移液器輕輕吹打至充分混勻,室溫靜置5 min。【注:如純化產(chǎn)物如需保存,可使用TE Buffer洗脫】。將PCR管短暫離心并置于磁力架中靜置,待溶液澄清后(約5 min),小心移取100 μL上清至新PCR管中,切勿觸碰磁珠。
3.3.2 雙輪分選操作步驟
1. 準(zhǔn)備工作:將Hieff NGS® DNA Selection Beads磁珠由冰箱中取出,室溫平衡約30 min。配制80%乙醇。
2. 請渦旋振蕩或充分顛倒磁珠以保證混勻。
3. 根據(jù)DNA片段長度要求,參考表8向上述100 μL DNA上清中加入第一輪分選磁珠,渦旋混勻或移液器吹打10次混勻。
表8 磁珠文庫分選推薦比例
DNA文庫插入片段大小
150 - 250 bp
200-300 bp
300-400 bp
400-500 bp
500-600 bp
DNA文庫大小
250 - 350 bp
350-450 bp
450-550 bp
550-650 bp
650-750 bp
第一輪體積比(Beads:DNA)
0.80×
0.70×
0.60×
0.55×
0.50×
第二輪體積比(Beads:DNA)
0.20×
0.20×
0.20×
0.15×
0.15×
【注】:表中“×”表示樣品DNA體積。如文庫插入片段長度為250 bp,樣品DNA體積為100 μL,則第一輪分選磁珠使用體積為0.70×100 μL=70 μL;第二輪分選磁珠使用體積為0.20×100 μL=20 μL;表中所推薦比例是針對于Adapter Ligated Insert DNA (Post Ligation),如果用戶在接頭連接前進(jìn)行分選,請采用Hieff NGS® DNA Selection Beads (Cat#12601)說明書中推薦的比例。
4. 室溫孵育5 min。
5. 將PCR管短暫離心并置于磁力架中,待溶液澄清后(約5 min),小心轉(zhuǎn)移上清到干凈的離心管中。
6. 參考表8向上清中加入第二輪分選磁珠。
7. 渦旋混勻或移液器吹打10次混勻,室溫靜置5 min。
8. 將PCR管短暫離心并置于磁力架中,待溶液澄清后(約5 min),小心移除上清。
9. 保持PCR管始終處于磁力架中,加入200 μL新鮮配制的80%乙醇漂洗磁珠,室溫孵育30 sec,小心移除上清。
10. 重復(fù)步驟9。
11. 保持PCR管始終處于磁力架中,開蓋干燥磁珠至剛剛出現(xiàn)龜裂(約5 min)。
12. 將PCR管從磁力架中取出,加入適量21 μL ddH2O,渦旋振蕩或使用移液器輕輕吹打充分混勻,室溫靜置5 min。
13. 將PCR管短暫離心并置于磁力架中分離磁珠和液體。待溶液澄清后(約5 min),小心轉(zhuǎn)移20 μL上清至干凈的管中。
3.4 文庫擴(kuò)增(Library Amplification)
該步驟將對純化或長度分選后的接頭連接產(chǎn)物進(jìn)行PCR擴(kuò)增富集。
1. 將表9中試劑解凍后顛倒混勻,置于冰上備用。
2. 于無菌PCR管中配制表9所示反應(yīng)體系。
表9 PCR擴(kuò)增反應(yīng)體系
名稱
體積 (μL)
2×Ultima Amplification Mix
25
Primer Mix
5
Adapter Ligated DNA(3.3步驟產(chǎn)物)
20
3. 使用移液器輕輕吹打或振蕩混勻,并短暫離心將反應(yīng)液收集至管底。
4. 將PCR管置于PCR儀中,設(shè)置表10所示反應(yīng)程序,進(jìn)行PCR擴(kuò)增。
表10 PCR擴(kuò)增反應(yīng)程序
溫度
時(shí)間
循環(huán)數(shù)
98 °C
1 min
1
98 °C
 10 sec
10 sec參照注意事項(xiàng)中表3
60 °C
30 sec
72 °C
30 sec
72 °C
5 min
1
4 °C
Hold
-
3.5 擴(kuò)增產(chǎn)物磁珠純化或分選 (Post-Amplification Clean Up/Size Selection)
同3.3.1步驟中純化操作步驟。使用Hieff NGS® DNA Selection Beads (0.9×,Beads:DNA=0.9:1)純化文庫擴(kuò)增產(chǎn)物。
如需分選,操作方法同3.3.2雙輪分選步驟(純化步驟可省略)。
3.6 文庫質(zhì)量控制
通常情況下,構(gòu)建好的文庫可通過濃度檢測和長度分布檢測來進(jìn)行質(zhì)量評價(jià),具體請參見注意事項(xiàng)六。
3.7 參考實(shí)例
使用Hieff NGS® Ultima DNA Library Prep Kit for Illumina®對100 ng FFPE樣本建庫(未分選),結(jié)果使用Agilent 2100 DNA 1000 Chip進(jìn)行檢測。
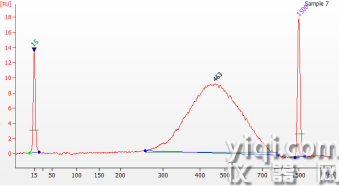
圖2 Ultima DNA建庫試劑盒用于FFPE樣本建庫(未分選)
您可能感興趣的產(chǎn)品
-
 Hieff NGS<sup>?</sup> Ultima DNA Library Prep Kit for Illumina<sup>?</sup> 全能型DNA建庫試劑盒
Hieff NGS<sup>?</sup> Ultima DNA Library Prep Kit for Illumina<sup>?</sup> 全能型DNA建庫試劑盒
-
 Hieff NGS<sup>?</sup> Ultima Pro DNA Library Prep Kit for Illumina<sup>?</sup>
Hieff NGS<sup>?</sup> Ultima Pro DNA Library Prep Kit for Illumina<sup>?</sup>
-
 Hieff NGS<sup>?</sup> Ultima DNA Library Prep Kit for MGI<sup>?</sup>
Hieff NGS<sup>?</sup> Ultima DNA Library Prep Kit for MGI<sup>?</sup>
-
 Hieff NGS<sup>?</sup> Ultima Dual-mode RNA Library Prep Kit for Illumina<sup>?</sup> 雙模式RNA 建庫試劑盒
Hieff NGS<sup>?</sup> Ultima Dual-mode RNA Library Prep Kit for Illumina<sup>?</sup> 雙模式RNA 建庫試劑盒
-
 Hieff NGS<sup>?</sup> Ultima Dual-mode mRNA Library Prep Kit for Illumina<sup>?</sup> 雙模式mRNA 建庫試劑盒
Hieff NGS<sup>?</sup> Ultima Dual-mode mRNA Library Prep Kit for Illumina<sup>?</sup> 雙模式mRNA 建庫試劑盒
-
 Hieff NGS<sup>?</sup> OnePot Pro PCR-Free DNA Library Prep Kit for Illumina<sup>?</sup>
Hieff NGS<sup>?</sup> OnePot Pro PCR-Free DNA Library Prep Kit for Illumina<sup>?</sup>
-
 Hieff NGS<sup>?</sup> Fast RNA Library Prep Kit for Illumina<sup>?</sup> 極速RNA建庫試劑盒
Hieff NGS<sup>?</sup> Fast RNA Library Prep Kit for Illumina<sup>?</sup> 極速RNA建庫試劑盒
-
 Hieff NGS<sup>?</sup> G-Type In-Situ DNA Binding Profiling Library Prep Kit for Illumina<sup>?</sup> CUT&Tag建庫試劑盒
Hieff NGS<sup>?</sup> G-Type In-Situ DNA Binding Profiling Library Prep Kit for Illumina<sup>?</sup> CUT&Tag建庫試劑盒
-
 Hieff NGS<sup>?</sup> MaxUp II DNA Library Prep Kit for Illumina? 全能型DNA建庫試劑盒
Hieff NGS<sup>?</sup> MaxUp II DNA Library Prep Kit for Illumina? 全能型DNA建庫試劑盒
-
 Hieff NGS<sup>?</sup> Ultima Pro PCR Free DNA Library Prep Kit 全能型DNA建庫試劑盒(PCR-Free)
Hieff NGS<sup>?</sup> Ultima Pro PCR Free DNA Library Prep Kit 全能型DNA建庫試劑盒(PCR-Free)
-
 Hieff NGS<sup>?</sup> Ultima Dual-mode mRNA Library Prep Kit for MGI<sup>?</sup> 雙模式mRNA 建庫試劑盒
Hieff NGS<sup>?</sup> Ultima Dual-mode mRNA Library Prep Kit for MGI<sup>?</sup> 雙模式mRNA 建庫試劑盒
-
 Hieff NGS<sup>?</sup> Ultima Dual-mode RNA Library Prep Kit for MGI<sup>?</sup> 雙模式RNA 建庫試劑盒
Hieff NGS<sup>?</sup> Ultima Dual-mode RNA Library Prep Kit for MGI<sup>?</sup> 雙模式RNA 建庫試劑盒